kaiyun平台官网登录 开云网站CRISPR 是什么?为什么科学界对它的潜在应用如此着迷?从其定义开始,我们将解释该技术如何利用一个古老的基于细菌的防御系统,以及它将如何影响当今的世界。
想象这样一个未来的场景,父母可以选择未出生孩子的身高和眼睛颜色等等,从而创造出他们定制的婴儿;想象一下可以根据自己的喜好定制所有你身边所有生物的特征:你家里养的宠物的大小,你家阳台上植物的寿命等等。
自 2012 年 CRISPR(也被称为 Cas9 或 CRISPR-Cas9)被首次发现以来,科学家一次一次地被它的应用所震撼。
CRISPR 可能会改变我们如何解决世界上一些最宏大的问题的思路,例如癌症、食物短缺和等等。最近甚至有报道其作为疾病高效诊断工具的新用途。但是,与任何新技术一样,它也可能引起新的意外问题。
当然,改变 DNA(生命准则)将不可避免地带来许多严重的问题。但是,如果不了解 CRISPR 的基础知识,这个社会和 CRISPR 行业就无法进行沟通,而沟通则是问题解决的基石。
在这篇文章中,我们从 CRISPR 的确切含义及其应用和局限性入手,对 CRISPR 进行介绍。
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)本质上是细菌体内一系列短的重复的 DNA 序列,在细菌体内起适应性免疫作用(类似于人类的获得性免疫)。它也被古细菌界的生物(单细胞微生物)使用。
CRISPR 附近始终伴随着它的基因称为 Cas(CRISPR-associated)基因,即下图序列中的左侧部分。Cas 基因一旦被激活就会产生一种特殊的酶,而这些酶似乎可以随着 CRISPR 共同进化。这些 Cas 酶的重要意义在于它们具有切入 DNA 的“分子剪刀”的能力。
细菌利用 CRISPR 基因序列来“记住”攻击它们的每种特定病毒,如下图右半部分所示。细菌首先将病毒的 DNA 整合到自己的基因组中,病毒 DNA 最终成为 CRISPR 序列中的间隔子,然后转录出 RNA,经过一些剪切之后,这些 RNA 可以指导带有 DNA 内切酶活性的 Cas 蛋白至目标外源 DNA 序列处,进而剪断外源 DNA 序列,实现对外来病原体的快速精确打击。
然后,当特定病毒再次尝试攻击时,此方法将为细菌提供保护或免疫力。并且,这些整合进基因组的外来 DNA 序列还可以继续传给子代细菌。
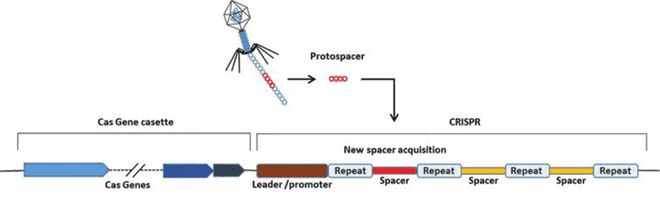
简单概括 CRISPR 在细菌内消灭入侵序列的作用机制:当病毒入侵细菌时,其独特的 DNA 被整合到细菌基因组中的 CRISPR 序列中。这意味着下次病毒攻击时,细菌会记住它,并发送 RNA 和 Cas 来定位和消灭病毒。
虽然还有其他源自细菌的 Cas 酶可以切断攻击细菌的病毒,但Cas9 是在动物体内效果最佳的酶。广为人知 CRISPR-Cas9 便是指用于切割动物(和人类)DNA 的一种 Cas 酶。
在利用这项技术时,研究人员增加了一个新步骤:当一段 DNA 序列被 CRISPR-Cas9 切割后,带有“修复”版本基因的新 DNA 序列可以嵌套在新的间隔子中。也就是说,切割过程可以完全“敲除”特定的有害基因,例如一些导致疾病的基因。
除了基本的编辑 DNA 之外,CRISPR 研究领域还在继续向外延展。2017 年 12 月,索尔克研究所(Salk Institute)设计了“残障人士”版的 CRISPR-Cas9 系统,可以实现在不编辑基因组的情况下打开或关闭目标基因的功能。这可以极大缓解人们对于基因编辑会永久性地改变基因的焦虑。
CRISPR 相关蛋白 9(Cas9):剪掉不需要的 DNA 片段的“剪刀”

向导 RNA 充当“GPS 坐标”,以找到想要编辑的 DNA 片段。完成定位之后,作为“剪刀”的 Cas9 就会使 DNA 双链断裂,而要插入的 DNA 将取代它。
虽然这项技术可能会使现代医学治疗陷入混乱。但在此之外,我们也可以通过基因编辑将我们吃的食物转化为燃料。
来自麻省理工学院和哈佛大学 Broad 研究所的张锋博士使用一句有趣的童谣描述了 CRISPR 编辑基因的过程。我们可以想象以如下这种方式修复某个 DNA 序列:
生物工程改造过的载体会在断裂处插入正确的 DNA 片段,也就是“小”这个字。
CRISPR 序列于 1987 年首次发现。20 多年后的 2008 年,微生物学家 Luciano Marraffini 与西北大学的 Erik Sontheimer 共同撰写了关于 CRISPR 的概论文章,但当时这两位科学家申请的相关专利却都被拒绝了,因为他们无法证明这一发现有任何具体的应用。
直到四年后的 2012 年,CRISPR 的功能及其惊人的潜力才被发现。最初发现细菌 CRISPR-Cas9 系统功能的关键人物包括加利福尼亚大学伯克利分校的 Jennifer Doudna 博士和法国科学家 Emmanuelle Charpentier 博士。他们的战略合作开启了生物技术的新时代。
另一个重要人物是张锋博士,他在 2013 年弄清了 CRISPR 在小鼠和人类细胞上的治疗应用。哈佛遗传学家 George Church 博士也为张锋早期的 CRISPR 研究做出了贡献。
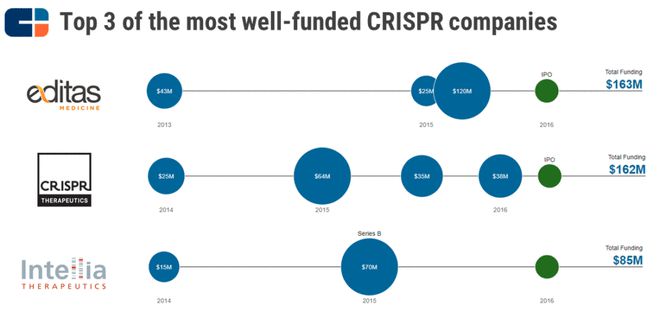
这四位研究人员在建立当今一些最为人所知的 CRISPR 治疗创业公司中继续扮着关键角色,这些公司包括Editas Medicine,CRISPR Therapeutics 和 Intellia Therapeutics。它们均于 2016 年上市,目前处于药物发现/临床前阶段,正在研发针对各种人类疾病的 CRISPR 治疗候选药物。
在 CRISPR 诞生之前,也有其他两种基因编辑技术在主导这一领域:锌指核酸酶(ZFNs)和转录激活因子样效应子核酸酶(TALENs)。目前使用这两个工具的研究工作仍在进行中。
像 CRISPR 一样,这些工具都可以切割 DNA。虽然它们的制造过程和使用过程都相对复杂,但他们具有自己的优势:ZFNs 可以更轻松地递送至所选的目标基因;TALENs 似乎比 CRISPR 具有更高的准确率,并且可以减少由基因编辑导致的“脱靶突变”。
这两个工具也分别具有非常重要的治疗应用:生物技术公司 Cellectis 使用 TALEN 基因编辑技术制备用于白血病治疗的 CAR-T 细胞,而 Sangamo BioSciences 生产的 ZFNs 可以使导致 HIV 感染的关键基因失效。值得注意的是,这些公司都拥有这些特定基因编辑方法的关键知识产权,这可能会使其他生物技术公司难以使用这些工具。
同时,再加上 CRISPR 的高效率、灵活性和便宜的价格,使其成为基因编辑技术当仁不让的焦点。尽管 CRISPR 可能会面临一些知识产权方面的问题,但是由于该系统具有如此广泛的应用,所以它在多个方面的研究依然在迅速推进。
每个行业都可以利用 CRISPR 作为工具:它可以创造人类疾病的新药疗法,帮助农民种植自带抗病原体能力的农作物,创造新物种,甚至还可以使已经灭绝的物种重生。
自从最初发现 CRISPR 基因编辑机制以来,其应用范围迅速增长。尽管其探索还处于早期阶段,“动物模型”已经为我们提供了如何操纵 CRISPR 的关键思路。
由于哺乳动物与人类基因的相似度在 90%以上,因此小鼠是 CRISPR 一个理想的实验对象。
在小鼠体内的实验表明,CRISPR 可以关闭与杜氏肌营养不良症(DMD)相关的缺陷基因,抑制与亨廷顿病相关的致命蛋白质的形成,并且可以清除 HIV 感染。
2015 年,中国科学家通过禁用 Myostatin 基因(它指导正常的肌肉发育)制造了两只超级肌肉小猎犬。在缺乏该基因的情况下,小猎犬表现出“肌肉肥大”的特性,从而创造出明显比非转基因狗更为强壮的狗。

CRISPR 的动物实验范围很广,还包括对长毛山羊进行基因工程改造以提高羊绒产量,对无角奶牛进行育种以避免繁琐的剪角过程等。
相比于动物实验,编辑人类 DNA 的 CRISPR 试验进展缓慢,这在很大程度上是由道德和法规问题所导致的。
鉴于改变人类基因组的永久性,FDA 依然在谨慎地考虑 CRISPR。一些科学家甚至提议暂停 CRISPR 试验,直到我们获得更多 CRISPR 对人类潜在影响的信息为止。
2018 年 5 月,FDA 要求 CRISPR Therapeutics 暂停其首次人类 CRISPR 试验计划,直到该公司回答完有关其治疗细节的问题为止。十月,FDA 解除了临床控制,并接受了 CRISPR Therapeutics 治疗镰状细胞病的研究性新药的申请。
大约在同一时间,宾夕法尼亚大学的研究人员开始了一项研究,评估对多发性骨髓瘤,黑色素瘤和肉瘤患者使用 CRISPR 治疗的安全性。
在欧洲,另一项对 CRISPR 治疗疗法的研究集中在一种称为 β -地中海贫血的血液疾病上,该疾病会导致异常的红细胞产生。CRISPR Therapeutics 与波士顿的 Vertex Pharmaceuticals 一起,于 2018 年 9 月正式开始其 β -地中海贫血疗法的首次临床试验。
尽管上述的研究都是开创性的,但这些并不是第一个使用 CRISPR 编辑人类遗传物质的研究。2017 年 8 月,俄勒冈健康与科学大学生殖生物学家 Shoukhrat Mitalipov 领导的一个团队获得了私人资金的支持,使用 CRISPR-Cas9 靶向可存活的人类胚胎中的一种可导致心肌增厚的突变,在实验室中,基因编辑后的胚胎恢复了 72% 的无突变状态(高于通常的 50% 遗传几率)。
一些批评家说,即使编辑后的胚胎并不会被转移和植入,对胚胎的基因编辑依然是不道德的。这种类型的测试并不能拿到联邦资助,而只能依靠私人捐赠者的资助。
会受到 CRISPR 冲击的领域包括医药、食品、农业和工业生物技术领域。得益于 CRISPR-Cas9 基因编辑系统的制造和使用的方便性,各个科学领域的研究人员都可以使用这一工具来对他们选择的有机体进行基因工程改造。
鉴于需要确保患者安全,并全面掌握各种预料之外的副作用,目前的药物研发生产过程非常漫长。而且,当下各国政府的监管政策通常会导致新药走完从研发到上市的整个流程需要数十年的时间。
但是,相比于这一较长时间的预期,使用 CRISPR 的团队可以更快地将定制疗法推向市场,从而加速传统药物研发流程。
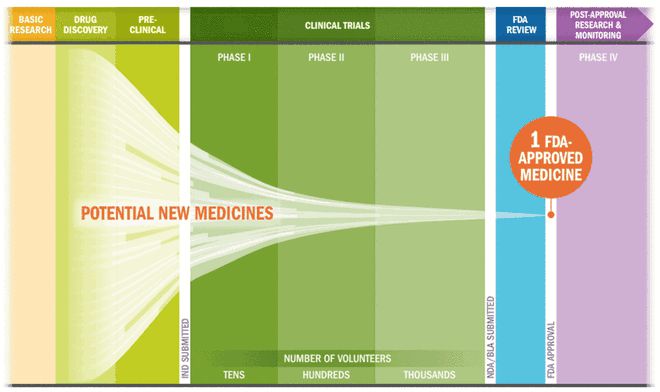
CRISPR 可准确、快速地识别潜在的基因靶标,以进行有效的临床前测试。因为 CRISPR 可以用来“敲除”不同的基因,这就为研究人员提供了一种更快、更实惠的方式来研究数十万个基因,来研究特定基因和特定疾病的关系。
当然,除了提供更简化的药物开发过程外,CRISPR 还提供了治疗患者的新方法。
例如,单基因疾病,即由单个基因突变引起的疾病,就为 CRISPR 治疗提供了一个有吸引力的起点。这些疾病的特性为治疗提供了确切的目标:解决单个基因上有问题的突变。
此外,血液类的单基因疾病(例如 β -地中海贫血或镰状细胞病)也很适合 CRISPR 治疗,因为它们都可以在体外进行治疗(称为离体治疗),患者的血细胞可以被取出患者体外,用 CRISPR 系统进行治疗之后回输人体。
尽管近年来人类在抗生素药物的开发方面取得了重大进展,但这同时,许多细菌感染菌株已对常规抗生素产生了高度抗性。根据疾病预防控制中心(CDC)的数据,每年耐抗生素病原体感染超过 200 万人,每年因此而死亡的患者可多达 23000 名。
威斯康星大学麦迪逊分校的药物科学教授杰森·彼得斯(Jason Peters)开发了一种分析抗生素对一系列病原细菌的疗效的新方法。这项名为 Mobile-CRISPRi 的技术减少了特定基因产生的蛋白质的数量,从而使科学家能够更精确地研究抗生素抑制细菌病原体的传播的过程。
与大多数 CRISPR 技术切割 DNA 链不同,Mobile-CRISPRi 仅阻止蛋白质访问和激活特定基因。彼得斯的技术已被应用于一系列常见的细菌感染的研究,包括李斯特菌、沙门氏菌和葡萄球菌,这可能有助于研究人员更好地去研究如何克服这些病原体对现有药物的耐药性。
酸奶公司 Danisco 在 2000 年代率先开发了 CRISPR 的早期应用,当时的科学家使用 CRISPR 的早期版本来对抗牛奶和酸奶培养物中发现的主要细菌(嗜热链球菌),该细菌一直被病毒感染。那时,人们还没搞清楚 CRISPR 的工作原理。
时间快进到今天,气候变化将进一步增加使用 CRISPR 保护食品和农业行业免受新细菌侵害的需求。例如,随着生长地区变得越来越干燥,可可豆变得越来越难以耕种。这一类环境变化将进一步加剧病原体造成的破坏。
为了解决这个问题,加州大学伯克利分校的创新基因组学研究所(IGI)正在应用 CRISPR 来创造可以抵抗疾病的可可豆。全球领先的巧克力供应商 MARS Inc. 正在支持这项工作。
基因编辑可以提高耕种效率。它可以遏制粮食作物的全球短缺,如土豆和西红柿等。同样,它可以生产出能抵御自然灾害的作物,它们能不受干旱和其他环境影响。
监管机构对基因编辑的农作物几乎没有抵触,尤其是美国农业部(USDA)并没有在监管这一领域。这主要是因为将 CRISPR 应用于农作物基因编辑时,不会向农作物的基因组中添加任何外源 DNA,CRISPR 仅仅通过编辑农作物自身的遗传基因以选择所需的性状。
2016 年,经过改良以抵抗褐变的白色纽扣蘑菇成为第一个被 CRISPR 编辑的生物体,其绕过了 USDA。2017 年 10 月,农业公司杜邦先锋和 Broad 研究所宣布合作,将利用 CRISPR-Cas9 进行农业研究。
最近,巴西和爱尔兰研究人员发表的一篇论文声称,CRISPR 基因编辑可以帮助农民种植像辣椒一样辣的西红柿。这篇论文着重介绍了辣椒素的基因操作,作为一个可以在包括西红柿在内的其他食品中栽培的特性的例子。
尽管辣椒素是一种非常有价值的化合物,从执法人员使用的胡椒喷雾剂到某些麻醉产品都可以用到,但由于辣椒的对生长环境要求苛刻,所以它们的种植难度很高。研究人员希望通过使用 CRISPR 重新激活西红柿中的一个基因(西红柿与辣椒具有相同的遗传祖先),从而使这种辣椒西红柿可以在更广泛的环境下生长。
以上这些例子表明,新品种的农作物进入市场的速度比想象的要快得多。没有美国农业部的监督,这些转基因植物产品可能会相对较快地投入生产。
这将会直接影响到我们吃的食物,因为食品经过编辑可以携带更多的营养或者获得更长的保质期。
2017 年 10 月,中国科学院的科学家使用 CRISPR 基因工程改造的猪肉少 24% 的脂肪。
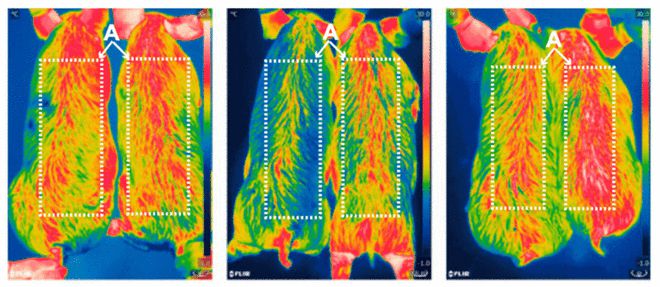
图 六个月大的猪在冷暴露后零,二,四个小时的红外照片。基因编辑的猪在图像的右侧。(来源: Zheng et al./PNAS)
CRISPR 的另一个关键但不太明显的用途是在工业生物技术领域。通过使用 CRISPR 重新改造微生物,研究人员可以创建新材料。
从工业角度来看,这对于修改和创建新的化学产品非常重要。我们可以改变微生物以增加多样性,创造新的生物基材料,并生产更有效的生物燃料。从香料中的活性化学物质到工业清洁相关的 CRISPR,在这里,CRISPR 可能会通过创造新型和更有效的生物材料而产生巨大影响。
詹妮弗·杜德纳(Jennifer Doudna)的第一家 CRISPR 创业公司 Caribou Biosciences 成立于 2011 年,其宗旨是跨行业进行非治疗研究。它是为各个行业提供使用CRISPR 进行多种用途的工具的主要公司之一。
这项新技术可能会带来意想不到的影响和未知变量,而随着人类试验的临近,新的道德问题和争议也不断涌现。
当使用 CRISPR 进行人类治疗时,安全是最大的问题。与任何新形式的技术一样,研究人员不确定 CRISPR 的全部作用范围。
脱靶活动是这里的主要问题。单个基因编辑可能会导致基因组其他地方发生意外活动。这种情况的可能后果是组织异常生长,从而导致癌症。随着更多的研究发现新的细节,这可能会导致更精确的基因靶向。
另一个问题是马赛克生成的可能性。在进行 CRISPR 治疗后,患者可能会同时拥有已编辑和未编辑的细胞——“马赛克”。随着细胞继续分裂和复制,某些细胞可能会得到修复,而其他细胞则无法修复。
最后,免疫系统并发症意味着这些干预和疗法可能会触发患者免疫系统产生不良反应。早期研究表明,免疫系统可能在 Cas 酶达到其目的之前就将其清除,或者可能产生不良反应,从而导致诸如炎症的副作用 (1999 年,美国一名患者死于严重的免疫反应,在进行 CRISPR 试验时使研究人员更加谨慎)。
不同的酶(“分子剪刀”)或更精确的递送载体可以降低脱靶活性。如果对卵或中修饰的干细胞(即可以成为人体每个细胞的细胞)进行编辑,则可以避免镶嵌。
由于存在免疫系统问题,研究人员可以从人类尚未具有适应性免疫力的细菌菌株中分离出不同的 Cas 蛋白,从而避免有害的免疫反应。同时,离体疗法(科学家将患者的血细胞带出体外,然后再将其输回体内进行治疗)也可以帮助绕过免疫系统。
CRISPR 的一个潜在的大限制是 CRISPR-Cas9 系统缺乏手术精度。Cas 酶切割了 DNA 双螺旋的两条链,而这种“双链断裂”使人们对切割的准确性产生了担忧。
目前,Cas9 酶作为“切割”酶受到了最广泛的关注,但科学家们正在积极寻找替代物以寻找更好的候选物。
其他选择包括较小版本的 Cas9 或完全不同的酶:Cpf1,由于其易于运输至目标 DNA 位置而广受欢迎。
除了使用其他 Cas 酶外,治疗基因的替代转运载体也是另一种选择。无害工程病毒可以将治疗基因携带到突变位点,而脂质纳米颗粒可以避免免疫系统的检测,从而避免免疫反应。两种选择都提出了有希望的研究途径。
当技术可以改变人们的生活习惯时,它的意义是深远的,它的争议也是如此。在这里,我们概述了有关 CRISPR 的一些主要争议。
按照这种逻辑,宠物主人可以用指定的颜色和大小设计他们想要的狗。而且,父母可以修改控制身高或眼睛颜色的基因来“设计”孩子。如果我们能够分离出与智力有关的基因,同样也可以操纵智力。
尽管批评家说该技术只可应用于治疗需求,但 CRISPR 的快速发展似乎并不会很快放缓,而且基因编辑的生物已经被创造出来用于非治疗目的。
2015 年,北京基因组研究所(BGI)通过去除与生长相关的基因创造了“微型猪”。重量仅为 30 磅,与猪的正常体重 100 磅相去甚远。BGI 最初希望以每只 1600 美元的价格出售微型猪,并为消费者提供定制的尺寸和颜色选择。计划最终在 2017 年被取消。
尽管 BGI 使用 TALENs 而非 CRISPR 来编辑猪的基因,但是 CRISPR 在“设计”未来宠物方面也存在类似的问题。该设计器应用程序展示了动物和人类进化方向上的永久性和不可逆转。
最近,中国科学家贺建奎被指控使用 CRISPR 创造了世界上第一个基因编辑的婴儿,这引发了关于 CRISPR 在人类基因组中应用的争论。尽管伦理问题陷入了舆论风暴中心,但他的研究背后的科学也受到许多科学家的关注。
贺的研究重点是 CCR5 基因,人类免疫缺陷病毒(HIV)通过健康细胞中的这一基因传播至全身。尽管这对双胞胎的父亲是艾滋病毒阳性,但两个孩子都没有感染。尽管如此,他还是继续使用 CRISPR 编辑婴儿的 CCR5 基因,为女孩的 CCR5 基因引入了三个新的基因突变。
虽然未来可能会改变,但就目前而言,备受争议的“设计婴儿”带有严重的伦理学问题和科学不确定性,因为 CRISPR 的许多研究仍处于高度实验阶段。
猛犸象最后一次出现在3600年前。如果能带回这些古老的生物,我们要这样做吗?目的是什么?无论是出于好奇还是出于有效的科学目的,目前业界已经有所争论。
简而言之,该过程涉及获取灭绝动物最近的亲戚的胚胎,并使用 CRISPR-Cas9 插入灭绝物种的 DNA,这样灭绝的动物就可以再次在地球上出现。
不同的科学团体和组织已经在实施这项试验。值得注意的是,The Long Now Foundation 的一个名为 “ Revive&Restore” 的项目旨在恢复灭绝的动物,如候鸽和猛犸象。博德研究所的遗传学家乔治·丘奇在该项目中发挥了重要作用。
使用 CRISPR 进行“种系修饰”使科学界嗅到了紧张的气息。体细胞修饰是在皮肤,大脑,肌肉和心脏细胞等体细胞上进行的,这些修饰不会传递给后代。另一方面,生殖细胞的修饰是在生殖卵或精细胞中携带的基因中完成的,因此将被后代继承。
这就提出了一个问题:在伦理角度,我们是否可以选择未来子孙后代的基因变成什么样?
对种系细胞进行基因改变的后果,解释了为什么直到最近,研究人员仅将无生命的人类胚胎用于 CRISPR 研究。在 2017 年 3 月,在中国进行了关于人类活胚的首次 CRISPR 实验。值得注意的是,该实验显示的基因编辑成功率要高于先前针对无生命胚胎的实验。
尽管存在争议,但改变种系细胞的明显好处是,随着个体的发展,疾病的自我表达可以被控制。生殖细胞疗法也保证可以到达患者体内的每个细胞。
生物黑客们表示,他们希望利用 CRISPR 加快之前冗长的研发流程,这引起了是否应该监管以及如何监管的问题。
生物黑客最近进行的众筹活动引起了很多关注。生物黑客初创公司 Odin 在其网站上出售 DIY 细菌 CRISPR 试剂盒,零售价为 159 美元。Odin 的首席执行官 Josiah Zayner 在 2017 年 10 月于旧金山举行的合成生物学会议上为自己注射了 CRISPR 修饰的肌肉生长基因。
目前,这种类型的生物黑客仍然不受管制,因为它是自我注射,而不是对其他人的实验。但是,FDA 确实禁止销售这种治疗方法,即使是用于自我注射。
即使在受到严格控制的临床环境中,遗传突变也可能是不可预测的。在 2018 年 7 月,分子生物学家 Lydia Teboul 写到,使用 CRISPR 试剂时,特别是在使用某些类型的遗传物质时,有很大可能产生不可预测的结果。
2017 年 5 月,哥伦比亚大学医学中心的研究人员发表了一篇现已撤回的论文,声称 CRISPR 可能会在编辑的基因组中引起数百种意想不到的基因突变。在未能重现其初步结果后,研究人员被迫于 2018 年 3 月撤回该论文,但有关 CRISPR 潜在副作用的许多问题尚未得到解答。
CRISPR 技术的未来应用本质上与生命本身的形式一样无限。尽管当前的举措主要针对治疗或食品技术,但 CRISPR-Cas9 系统也有一些不太突出但非常实际的应用。
由于对的需求很高,而且没有合适的供应,因此异种移植(这里是 FDA 的定义)可以成为许多等待的病人的解决方案。
干细胞通过 Cas9 进行“培养”,并定向成为某种细胞类型(即心脏,肝脏,胰腺等)。
总部位于加利福尼亚州的 Salk 研究所于 2017 年 1 月宣布它制造了一种由猪和人细胞组成的嵌合体,在科学界引起了很大轰动。
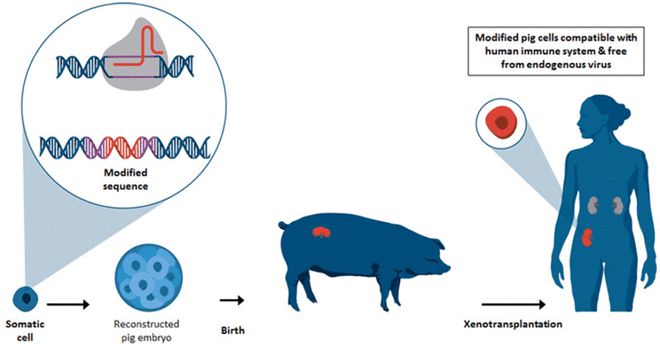
异种移植先前已在具有大鼠干细胞的小鼠中进行了测试:CRISPR-Cas9 用于关闭可在小鼠中形成胰腺的基因,而是将大鼠干细胞插入小鼠胚胎中。按照程序,小鼠继续生长大鼠胰腺。
后来,研究人员在猪胚胎中插入了人类干细胞。由于安全和有效性方面的考虑,该研究在第 4 周停止。研究人员确实注意到,一些干细胞专门用于这些猪的胚胎,这意味着它们正在开始变成人体组织。尽管这种成功的发生率低于老鼠胚胎中大鼠胰脏的成功水平,但这仍然是相当科学的壮举。
eGenesis 由乔治·丘奇(George Church)共同创立,也在这一领域开展工作,其目标是制造供人类使用的猪器官。2017 年 8 月,科学家对猪胚胎中的 60 多个基因进行了修饰,以消除在移植场景中人体会排斥的逆转录病毒。
如果研究人员想出一种在活体动物中生长人类细胞的方法,他们可以创造出与患者特别匹配的器官。每个患者的干细胞都可以产生由他或她自己独特的 DNA 组成的工程器官,从而减少排斥的风险和器官衰竭的其他后果。
没有蚊子的未来,也就是没有疟疾,寨卡病毒,基孔肯雅病毒,登革热的未来。没有这些昆虫来传播疾病,世界各地的生命将得以挽救。
CRISPR 可以帮助我们实现这个梦想。从表面上看似乎是个好主意,然而,这可能会导致灾难性的后果。
通常,每个基因都有 50% 的机会被遗传。但是基因驱动提供了一种使某些遗传结果更有利的方法。如果科学家使用基因编辑技术改变基因驱动力,他们将创造出快速的进化途径。
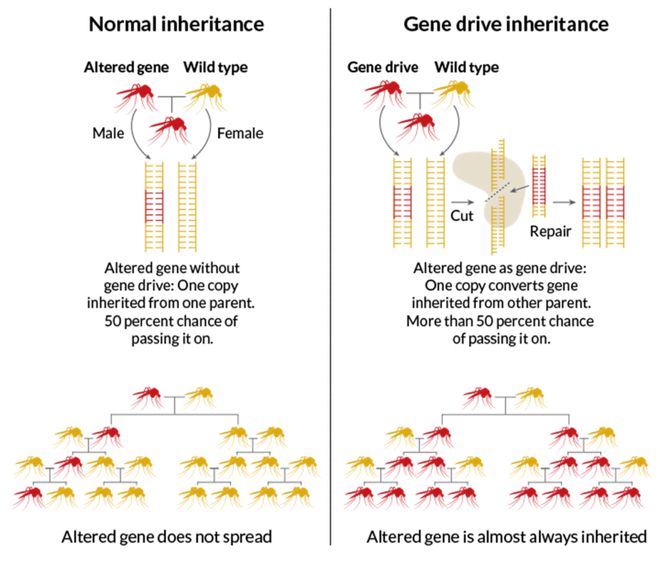
2016 年 12 月,伦敦帝国理工学院的研究人员,构想了一种消除携带疟原虫的整个蚊子种群的方法。该计划涉及使用 CRISPR 添加 DNA 序列,以确保无疟疾的蚊子胚胎的遗传偏向。随着这些无病蚊子的发展和成熟,它们会与种群中的其他野生蚊子交配,并最终停止携带疟疾。
尽管该技术显示出希望,但基因驱动技术尚未完全成熟。一些专家担心,那些基因序列已被改变的动物进入野外种群,可能会无意中给环境中的不利因素更多的时间发展抗性。
由美国国家情报局前局长詹姆斯·克拉珀(James Cler)在 2016 年 2 月发布的《美国情报界全球威胁评估》中陈述,“基因组编辑”被列为“大规模毁灭和扩散武器”概述的潜在自然安全威胁。
像 EcoNexus 和 ETC Group 这样的遗传监督组织警告说,基因编辑会被滥用。CRISPR 可以通过对新病原体的工程改造来产生新一代生物武器,或者为生物提供灵感。如果昆虫能够携带和传递毒素,那么可能会使用这项技术。
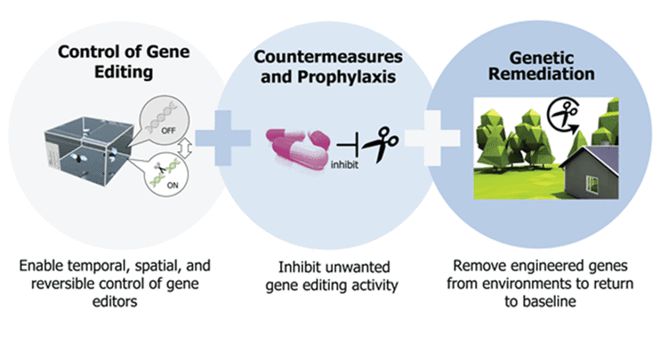
DARPA 已经在为这种情况做准备,并开发解毒剂,因为它们致力于寻找可以逆转有害基因驱动效应的解决方案。
Jennifer Doudna 与她的同事 Emmanuelle Charpentier(现在是柏林马克斯·普朗克感染生物学研究所所长)一起发明了最初的 CRISPR 技术而广受赞誉。两位科学家于 2012 年 5 月向美国专利和商标局(USPTO)申请了第一项专利。2012 年 8 月,Doudna 和 Charpentier 在《科学》杂志上发表了被认为是关于 CRISPR-Cas9 的第一篇学术论文。
六个月后,麻省理工学院和哈佛大学的 Eli and Edythe L.Broad Institute 向美国专利商标局(USPTO)申请了 CRISPR-Cas9 修饰真核细胞 DNA 序列的方法的专利,该方法是由分子生物学家张锋开发的一种方法 。
后来,加州大学伯克利分校(UC Berkley)向美国专利商标局提起诉讼,指控张的专利侵犯了 Doudna 和 Charpentier 的工作,并要求张的专利无效。这引发了长达三年多的关于 CRISPR 知识产权的激烈斗争。
CRISPR-Cas9 关键专利的争夺最终于 2017 年 2 月由美国专利商标局授予了 Broad 研究所。不过,欧洲专利局(EPO)于 2018 年 1 月撤销了 Broad 的一项专利,理由是该专利不包括纽约洛克菲勒大学微生物学家 Luciano Marraffini 的贡献。这一遗漏使 Broad 研究所无法要求美国最早的专利申请的优先权日期,这意味着 Broad 研究所的研究人员声称自己是第一个在真核生物专利中使用 CRISPR 的人,并不符合 EPO 标准。
CRISPR 基本技术的知识产权问题目前似乎已解决。然而,随着 CRISPR 基因编辑技术的变化和专业化,可能会发生类似的法律斗争。
在 100 年,50 年甚至 10 年内,基因编辑的面貌可能会完全不同。
将来,对植物,动物甚至人类中的基因进行调整或设计可能会成为标准做法,从而对基因库和进化过程产生不可逆转的影响。
尽管目前上面提出的一些想法目前看来有些牵强,但这很容易会变。毕竟,CRISPR 并不是一种昂贵的、难以获得的技术形式。它已经可用并且正在使用中。从农民到研究人员,CRISPR 都会对我们的社会产生影响。